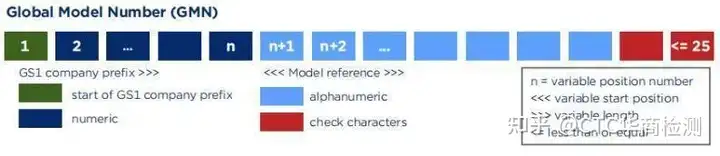
Basic-UDI申请详细流程和链接是什么?哪里可以查询?
2017年4月,欧盟医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)发布,法规中定义了欧盟UDI系统的相关要求此外,可通过该标识对欧盟医疗器械数据库(EUDAMED)中的医疗器械进行分组,为了

2017年4月,欧盟医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)发布,法规中定义了欧盟UDI系统的相关要求此外,可通过该标识对欧盟医疗器械数据库(EUDAMED)中的医疗器械进行分组,为了
医疗器械法规 – MDR (EU 2017/745) 和体外诊断法规 – IVDR (EU 2017/746) 要求公司配备一名监管合规负责人 (PRRC)。 PRRC 是一位监管专家,其职责是确保公

ANVISA,全称Agência N.acional de Vigilancia Sanitária,隶属巴西卫生部,负责所有医疗器械、体外诊断产品及其他健康相关产品(如药品、卫生用品、化妆品等)的上

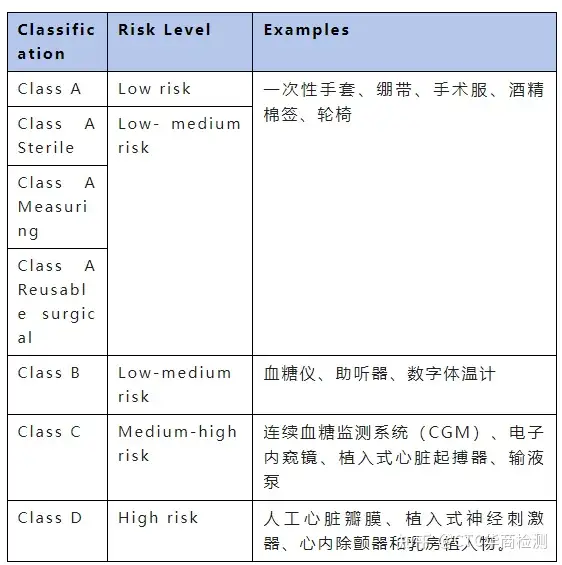
一般来说,医疗器械分类与产品类型的感知风险有关。它是“一个基于风险的系统,基于人体的脆弱性,并考虑到与设备相关的潜在风险。医疗器械MDR分类:医疗器械法规(MDR)将医疗器械分为以下风险类别:一类:非
ISO13485标准是适用于医疗器械法规环境下的质量管理体系标准,其全称是《医疗器械 质量管理体系 用于法规的要求》。它采用了基于ISO9001标准中PDCA的相关理念,相较ISO9001标准适用于所

随着《2022 年化妆品监管现代化法案》(MoCRA) 的通过,美国国会扩大了 FDA 对化妆品在美国如何分销和营销的权力,并详细说明了化妆品负责人的新角色。根据 MoCRA 的规定,整个行业都必须遵
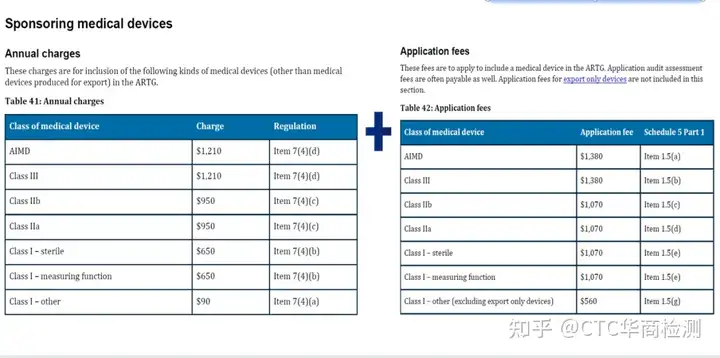
澳大利亚拥有强大的医疗保障体系,完备的医疗管理和保险体系为人民提供着完整的医疗卫生服务。目前所有在澳大利亚上市的医疗用品(药品和医疗器械)必须按有关要求,向澳大利亚医疗用品管理局提出注册或登记申请,获
沙特食品药品监督管理局(SFDA) 负责监管沙特阿拉伯的医疗器械产品, 确保其安全、有效和质量稳定。所有医疗器械产品在销售产品之前必须获得SFDA批准的医疗器械上市授权medical devices

医疗器械许可证(MDL)和医疗器械企业许可证(MDEL)是加拿大卫生部颁发的许可证,用于监管在加拿大市场销售的医疗器械。在加拿大市场上,医疗器械分为四类,分别是I类、II类、III类和IV类。本文将详

美国材料与试验协会(ASTM)于2020年3月发布了其消费品委员会(F15)珠宝分委员会(F15.24)准备的关于儿童珠宝的消费者安全规范标准ASTM F2923-20。美国珠宝饰品主要法规标准如下: